-
- 1.1 Ашылу тарихы
- 1.2 Вольфрам мен молибденнің физикалық және химиялық қасиеттері, қолдану саласы
- 1.3 Вольфрамның өндірістік шикізаттары
- 1.4 Вольфрам концентраттарын өңдеу. Вольфрам үшоксидінің өндірісі
- 1.5 Молибденнің өндірістік шикізаттары
- 1.6 Молибден концентраттарын өңдеу. Молибден үшоксидінің өндірісі
- 1.7 Металдық вольфрам мен молибден ұнтақтарын өндіру
- 1.8 Ұнтақты металлургия әдісімен тұтас металдық вольфрам және молибден алу
- 1.9 Молибден мен вольфрамды балқыту
- 1.10 Вольфрам мен молибденді қысыммен өңдеу
-
- 4.1 Жалпы мәліметтер
- 4.2 Титан, цирконий және гафнийдің қолдану салалары
- 4.3 Титанның химиялық қосылыстарының өндірісі
- 4.4 Титан диоксиді өндірісі
- 4.5 Цирконий мен гафнийдің химиялық қосылыстарын өндіру
- 4.6 Кеуекті және ұнтақ тәрізді титан, цирконий және гафний өндірісі
- 4.7 Тұтас металдық титан және цирконий өндірісі
-
- 5.1 Ашылу тарихы
- 5.2 Ренийдің қасиеттері
- 5.3 Ренийдің шикізат көздері
- 5.3.1 Ренийдің дәстүрлі емес шикізаттары
- 5.4 Сульфидті молибденит концентраттарын өңдеуде ренийдің таралуы
- 5.5 Сульфидті мыс концентраттарын өңдеуде ренийдің таралуы
- 5.6 Ренийді қайтармалы шикізаттар мен техногенді өнімдерден бөліп алу
- 5.6.1 Ренийді техногенді өнімдерден бөліп алу әдістері
- 5.6.2 Ренийді қолданыстан шыққан немесе жарамсыз катализаторлардан бөліп алу әдістері
- 5.6.3 Ренийді ренийқұрамды қорытпалардан бөліп алу
- 5.7 Ренийді ерітінділерден бөліп алу технологиясы және аммоний перренатын алу
- 5.8 Ұнтақты және тұтас металдық рений өндірісі
Мазмұны
1.7 Металдық вольфрам мен молибден ұнтақтарын өндіру
Балқу температурасы жоғары болғандықтан вольфрам мен молибденді тұтас металдық формасына дейін тотықсыздандыру қиын. Сондықтан олардың қосылыстарын тотықсыздандыруды ұнтақ метал алуға дейін жүргізеді. Кейін ұнтақты металлургия немесе вакуумды балқыту (доға немесе электронды-сәулелі) әдісі арқылы тұтас металдарға айналдырады.
Вольфрам мен молибденнің жоғары оксидтерін сутегімен немесе көміртегімен тотықсыздандыру арқылы, галогенидтерін (\(\small \text{WF}_6, \text{MoF}_6, \text{WCl}_6, \text{MoCl}_5\)) сутегімен тотықсыздандыру арқылы немесе қосылыстарын балқыту арқылы электролиттік тотықсыздандыру арқылы вольфрам мен молибденнің металдық ұнтақтарын алуға болады.
Өнеркәсіптік тәжірибеде кең таралған әдіс - \(\small \text{WO}_3\) және \(\small \text{MoO}_3\) оксидтерін сутегімен тотықсыздандыру әдісі. Көміртегі оксидтерімен тотықсыздандырылып алынған вольфрам және молибденнің металдық ұнтақтары пластикалық металдарды өндіруге жарамсыз, өйткені олардың құрамында металдардың сынғыштығын арттыратын карбидтер бар. Көміртекпен тотықсыздандырып алынған ұнтақтарды кейде қатты қорытпаларды өндіруде қолданылады (вольфрам карбидін алу үшін), алайда бұл салада да сутекпен тотықсыздандыру әдісінің артықшылығы бар деп саналады. Вольфрам және молибденнің металдық ұнтақтарын (жұқа дисперсті немесе үлкен сфералық) олардың фториді мен хлорид буларын сутегімен тотықсыздандыру арқылы алады. Мұндай тәсілмен алынған ұнтақтардың тазалығы жоғары, атап айтқанда оттегінің мөлшері аз.
Графиттің, металдардың немесе керамикалық бұйымдардың бетіне вольфрам және молибденді жабындар алу үшін олардың карбонилді қосылыстарын термиялық диссоциациялау әдісі, сондай-ақ галогенидтерін сутегімен тотықсыздандыру әдісі қолданады. Электролиттік әдістердің практикалық қолданысы аз.
Иілгіш металдарды алуға жіберілетін вольфрам және молибден ұнтақтары өте жоғары тазалықта болуы керек. Сонымен қатар, бұл ұнтақтардың гранулометриялық құрамы нақтыланған өлшемдерге сай келуі керек, өйткені ұнтақты металлургия әдісімен тұтас металдарды алу режимдері мен күйдірілген бұйымдардың қасиеттері бастапқы метал ұнтақтарының өлшеміне байланысты.
Вольфрам үшоксидінің сутегімен тотықсыздануы
Процестің физикалық - химиялық негіздері
Вольфрам-оттегі (1.19-сурет) жүйесінде төрт оксиді бар: сары \(\small \text{WO}_3\), көк \(\small \text{WO}_{2.9}\) немесе \(\small \text{W}_{20}\text{O}_{58}\), күлгін \(\small \text{WO}_{2.72}\) (немесе \(\small \text{W}_{18}\text{O}_{49}\)) және қоңыр \(\small \text{WO}_2\). Тиісінше \(\small \text{WO}_3\) сутегімен тотықсыздануы төрт сатыда жүреді:
\[
\begin{align*}
\small \ce{WO3 + 0,1H2 & <=> WO2.9 + 0,1H2O}, \quad \Delta H^\circ_{298} = +167 \, \text{кДж/моль}; \quad (1.61) \\
\small \ce{WO2.9 + 0,18H2 & <=> WO2.72 + 0,18H2O}, \quad \Delta H^\circ_{298} = +69,5 \, \text{кДж/моль}; \quad (1.62) \\
\small \ce{WO2.72 + 0,72H2 & <=> WO2 + 0,72H2O}, \quad \Delta H^\circ_{298} = +21,8 \, \text{кДж/моль}; \quad (1.63) \\
\small \ce{WO2 + 2H2 & <=> W + 2H2O}, \quad \Delta H^\circ_{298} = +38,4 \, \text{кДж/моль}; \quad (1.64)
\end{align*}
\]
Жалпы реакция:
\[
\small \ce{WO3 + 3H2 <=> W + 3H2O} \quad (1.65)
\]
Барлық реакциялар эндотермиялық. Тиісінше, тепе-теңдік константалары (\(\small K_t = \frac{\rho_{\text{H}_2\text{O}}}{\rho_{\text{H}_2}}\)) температураға байланысты жоғарылайды. Температураға тәуелділіктің әр кезеңі үшін Кт келесі теңдеулермен сипатталады:
\[
\begin{align*}
\small \lg K_t & = \frac{-3266.9}{T} + 4.0667 \quad (1.61); \\
\small \lg K_t & = \frac{-4508}{T} + 5.1086 \quad (1.62); \\
\small \lg K_t & = \frac{-904}{T} + 0.9054 \quad (1.63); \\
\small \lg K_t & = \frac{-2325}{T} + 1.650 \quad (1.64).
\end{align*}
\]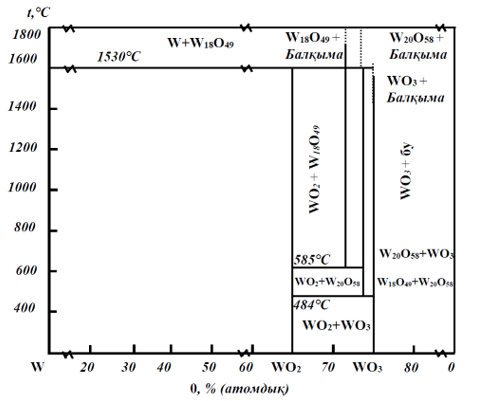
Графикалық түрде бұл тәуелділіктер 1.20-суретте l\(\small \lg K_т = -\frac{l}{T}\) координаттарында көрсетілген. Газ фазасының тепе-теңдік құрамын сипаттайтын түзулер арасында вольфрам оксидтерінің тұрақтылық аймақтары орналасқан. Соңғы кезең үшін (\(\small \text{WO}_2 \rightarrow \text{W}\)) тепе-теңдік константалары салыстырмалы түрде аз мәндерге ие (700, 800 және 900 ℃-де Кт сәйкесінше 0,18; 0,3; және 0,465). Алайда, \(\small \text{WO}_2\)-ні \(\small \text{W}\)-ге дейін тотықсыздандыру су буының өте жоғары концентрациясында (700 ℃-де ≤23% \(\small \text{H}_2\text{O}\)) термодинамикалық түрде жүруі мүмкін. Өндірістік тәжірибеде процесті жылдамдату үшін құрғатылған сутегі қолданылады.
Тотықсыздандырудың екінші және үшінші сатыларына сәйкес келетін 1.20-суретте көрсетілген түзулер 585 ℃-де қиылысады. Сондықтан осы температураның төмен мәнінде \(\small \text{WO}_{2.9}\) оксиді \(\small \text{WO}_{2.72}\) түзілу сатысын айналып өтіп, \(\small \text{WO}_2\)-ге дейін тотықсызданады.
\(\small \text{WO}_3\)-нің сутегімен тотықсыздануы - қатты бетке сутектің диффузиялық берілуінен, сутектің химосорбциясы және беттегі химиялық реакциядан, десорбциядан және су буының диффузиялық бөлінуінен